
Rövid összefoglaló
Előzetes információ
Az influenza A vírusok (IAV) világszerte fertőzéseket okoznak, melyek évente félmillió halálesethez vezetnek. Az influenza járványok a téli hónapokban törnek ki a mérsékelt éghajlati övezetben. Tetőpontjukat november és március között érik el az északi félgömbön, és május és szeptember között a déli félgömbön. Az epidémia fő kiváltói a hőmérséklet-ingadozás, az alacsony páratartalom, többen tartózkodnak beltéren, a napfény hiánya és az ehhez kapcsolódó D-vitamin hiánya.
Eredmény
Akiko Iwasaki és társai részletes tanulmánya ismét rámutat*, hogy a túl alacsony páratartalom jelentősen megnöveli az influenzafertőzések kialakulásának lehetőségét. (*Lipsitch et al. 2010, 30 éves tanulmány)
A túl alacsony 10–20% relatív páratartalom közti légnedvesség csökkenti a légutak öntisztító mechanizmusát, a vírusok elleni ellenállóképességet, valamint az immunrendszer memóriasejtjeinek működőképességét. Magasabb relatív páratartalom (50%) esetén nem következnek be ezek a csökkentő hatások.
Az immunrendszer három védelmi vonala a fertőzésekkel szemben
A vírusfertőzés ellen az immunrendszer három védelmi vonala véd minket. Az első védelmi vonalat a nyálkahártya, a nyálkahártya folyadékrétege és a felület védősejtjei jelentik. Ezek lehetővé teszik a légutakon keresztül behatoló kórokozók és részecskék elhárítását. Amennyiben a vírus áthatol az immunrendszer első védelmi vonalán, a szervezet interferonnal aktiválja azokat a géneket, melyek leküzdik ill. blokkolják a vírusokat. Amennyiben egy vírus átjut a második védelmi vonalon is, aktiválódik a harmadik szint, az adaptív immunrendszer, mely az adott vírusra specializálódott immunválaszt ad T és B sejtek segítségével.
Ez a három védelmi vonal azonban hatástalan, ha huzamosabb ideig tartózkodunk alacsony páratartalmú helyiségben (10–20%). Az influenzamegbetegedés úrrá lesz rajtunk.
A megbetegedés 10–20% relatív páratartalom esetén súlyosbodik, függetlenül a vírus által okozott terheléstől. Továbbá gátolja a sejtszövetek regenerálódását.
Az influenzamegbetegedés 50% relatív páratartalom esetén gyengébb, alacsonyabb lázzal jár, és gyorsabb lefolyású.
Dr. Akiko Iwasaki tanulmánya
Mit befolyásol a páratartalom immunrendszerünkben?
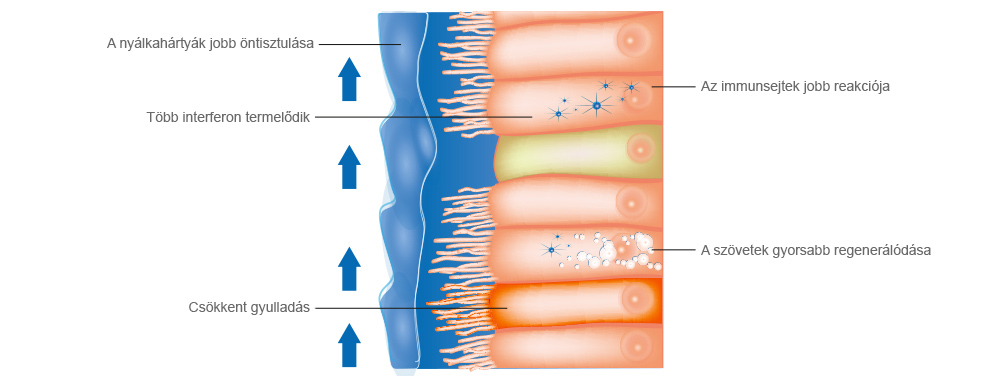
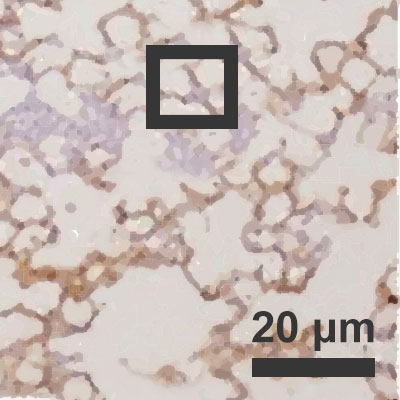 Fertőzött léghólyagok
Fertőzött léghólyagok 10% páratartalom esetén
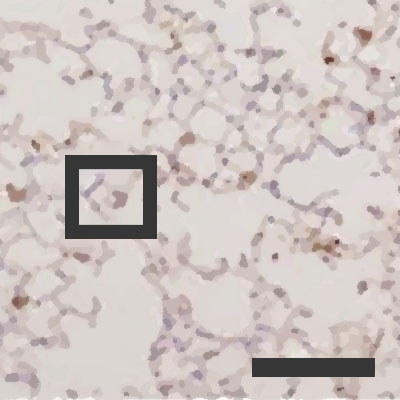 Fertőzött léghólyagok
Fertőzött léghólyagok 50% páratartalom esetén
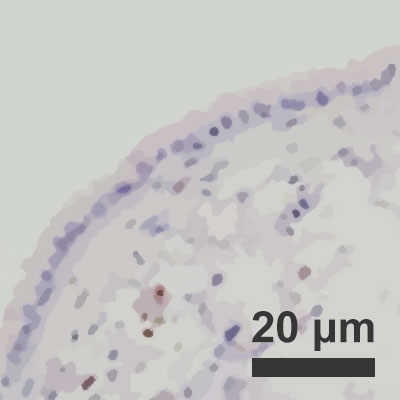 Fertőzött léghólyagok regenerálódó képessége 10% páratartalom esetén
Fertőzött léghólyagok regenerálódó képessége 10% páratartalom esetén
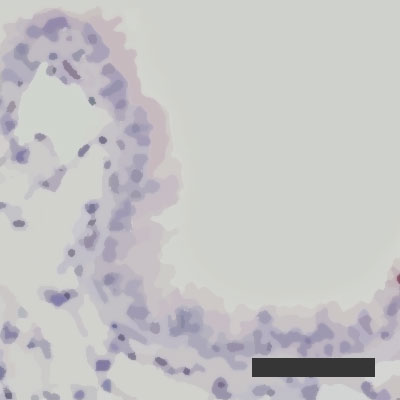 Fertőzött léghólyagok regenerálódó képessége 50% páratartalom esetén
Fertőzött léghólyagok regenerálódó képessége 50% páratartalom esetén
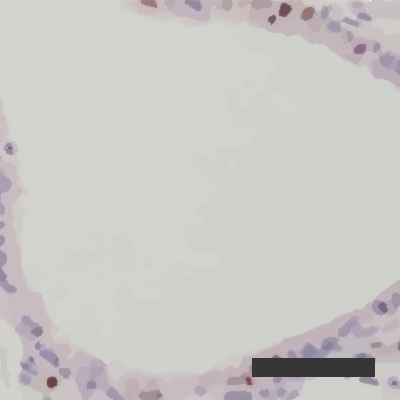 Fertőzött léghólyagok regenerálódó képessége 10% páratartalom esetén
Fertőzött léghólyagok regenerálódó képessége 10% páratartalom esetén 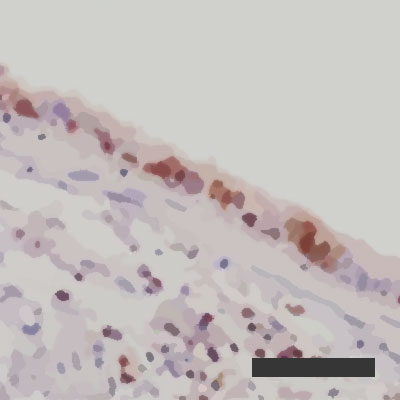 Fertőzött léghólyagok regenerálódó képessége 50% páratartalom esetén
Fertőzött léghólyagok regenerálódó képessége 50% páratartalom esetén
2 Kérdés Dr. Akiko Iwasaki számára
Hogyan hat a kiegyensúlyozott páratartalom azokra a személyekre, akik ki vannak téve az influenzavírusnak?
Hogyan néz ki a kiegyensúlyozott páratartalom védelmi mechanizmusa?
Már évtizedekkel korábban felismertük, hogy az influenzavírusok főleg télen jelentkeznek, amikor a belső helyiségeket fűtjük. A lehetséges okok, melyek a téli influenza megbetegedéseket kiváltják, ma is gyakran képezik vita tárgyát. A szezonális előfordulás kiváltói többek között a hideg hőmérséklet okozta expozíció, a belső helyiségek vagy a szabad levegő alacsony páratartalma, az emberek belső terekben történő csoportosulása, ahol nagyobb valószínűséggel kerül sor fertőző cseppek átadására, valamint a napsütéses órák alacsony száma miatt bekövetkező D-vitamin hiánya.
Nem csak elméletileg érdekes megérteni a szezonális influenza okait, és ezáltal megtudni, milyen intézkedésekkel lehetne csökkenteni az ezzel kapcsolatos megbetegedések és halálozások valószínűségét. A téma különös jelentőséggel bír, ugyanis a szezonális influenzafertőzések továbbra is növekednek, és világszerte évente legalább félmillió halálos áldozatot követelnek. Az egyenletes páratartalom biztosítása egy védelmi intézkedés, mely segíti a védőoltást, és milliók életét mentheti meg.
Ebben a tanulmányban rámutattunk, hogy a száraz beltéri levegő erősíti az influenza hatását. Azt is bebizonyították, hogy a 40 és 60% közötti relatív páratartalom csökkenti a vírus okozta fertőzéseket és megnehezíti a vírus terjedését. Ez az első tanulmány, mely rámutat a pozitív eredmények mögötti fiziológiai mechanizmusokra, melyeket a kiegyensúlyozott páratartalommal sikerült elérni.
Hogyan hat a kiegyensúlyozott páratartalom azokra a személyekre, akik ki vannak téve az influenzavírusnak?
Hogyan néz ki a kiegyensúlyozott páratartalom védelmi mechanizmusa?
Már évtizedekkel korábban felismertük, hogy az influenzavírusok főleg télen jelentkeznek, amikor a belső helyiségeket fűtjük. A lehetséges okok, melyek a téli influenza megbetegedéseket kiváltják, ma is gyakran képezik vita tárgyát. A szezonális előfordulás kiváltói többek között a hideg hőmérséklet okozta expozíció, a belső helyiségek vagy a szabad levegő alacsony páratartalma, az emberek belső terekben történő csoportosulása, ahol nagyobb valószínűséggel kerül sor fertőző cseppek átadására, valamint a napsütéses órák alacsony száma miatt bekövetkező D-vitamin hiánya.
Nem csak elméletileg érdekes megérteni a szezonális influenza okait, és ezáltal megtudni, milyen intézkedésekkel lehetne csökkenteni az ezzel kapcsolatos megbetegedések és halálozások valószínűségét. A téma különös jelentőséggel bír, ugyanis a szezonális influenzafertőzések továbbra is növekednek, és világszerte évente legalább félmillió halálos áldozatot követelnek. Az egyenletes páratartalom biztosítása egy védelmi intézkedés, mely segíti a védőoltást, és milliók életét mentheti meg.
Ebben a tanulmányban rámutattunk, hogy a száraz beltéri levegő erősíti az influenza hatását. Azt is bebizonyították, hogy a 40 és 60% közötti relatív páratartalom csökkenti a vírus okozta fertőzéseket és megnehezíti a vírus terjedését. Ez az első tanulmány, mely rámutat a pozitív eredmények mögötti fiziológiai mechanizmusokra, melyeket a kiegyensúlyozott páratartalommal sikerült elérni.
Szerzők
Eredeti cím: Low ambient humidity impairs barrier function and innate resistance against influenza infection
Forrás: www.pnas.org/content/early/2019/05/07/1902840116
Közzététel: 13.05.2019
1. Wong GH, Goeddel DV (1986) Tumour necrosis factors alpha and beta inhibit virus replication and synergize with interferons. Nature 323:819–822.
2. Johnson NB, et al.; Centers for Disease Control and Prevention (CDC) (2014) CDC National Health Report: Leading causes of morbidity and mortality and associated behavioral risk and protective factors–United States, 2005-2013. MMWR Suppl 63:3–27.
3. Tamerius JD, et al. (2013) Environmental predictors of seasonal influenza epidemics across temperate and tropical climates. PLoS Pathog 9:e1003194, and erratum 2013 Nov;9(11).
4. Alonso WJ, et al. (2015) A global map of hemispheric influenza vaccine recommendations based on local patterns of viral circulation. Sci Rep 5:1–6.
5. Tamerius J, et al. (2011) Global influenza seasonality: Reconciling patterns across temperate and tropical regions. Environ Health Perspect 119:439–445.
6. Cannell JJ, et al. (2006) Epidemic influenza and vitamin D. Epidemiol Infect 134:1129– 1140.
7. Lowen AC, Steel J (2014) Roles of humidity and temperature in shaping influenza seasonality. J Virol 88:7692–7695.
8. Eccles R (2002) An explanation for the seasonality of acute upper respiratory tract viral infections. Acta Otolaryngol 122:183–191.
9. Shaman J, Pitzer VE, Viboud C, Grenfell BT, Lipsitch M (2010) Absolute humidity and the seasonal onset of influenza in the continental United States. PLoS Biol 8: e1000316.
10. Lowen AC, Mubareka S, Steel J, Palese P (2007) Influenza virus transmission is dependent on relative humidity and temperature. PLoS Pathog 3:1470–1476.
11. Iwasaki A, Pillai PS (2014) Innate immunity to influenza virus infection. Nat Rev Immunol 14:315–328.
12. Chen X, et al. (2018) Host immune response to influenza a virus infection. Front Immunol 9:320.
13. Garber EA, Hreniuk DL, Scheidel LM, van der Ploeg LHT (1993) Mutations in murine Mx1: Effects on localization and antiviral activity. Virology 194:715–723.
14. Staeheli P, Grob R, Meier E, Sutcliffe JG, Haller O (1988) Influenza virus-susceptible mice carry Mx genes with a large deletion or a nonsense mutation. Mol Cell Biol 8: 4518–4523.
15. Pillai PS, et al. (2016) Mx1 reveals innate pathways to antiviral resistance and lethal influenza disease. Science 352:463–466.
16. Taubenberger JK, Morens DM (2008) The pathology of influenza virus infections. Annu Rev Pathol 3:499–522.
17. Short KR, et al. (2016) Influenza virus damages the alveolar barrier by disrupting epithelial cell tight junctions. Eur Respir J 47:954–966.
18. Bustamante-Marin XM, Ostrowski LE (2017) Cilia and mucociliary clearance. Cold Spring Harb Perspect Biol 9:a028241.
19. Verhelst J, Parthoens E, Schepens B, Fiers W, Saelens X (2012) Interferon-inducible protein Mx1 inhibits influenza virus by interfering with functional viral ribonucleoprotein complex assembly. J Virol 86:13445–13455.
20. Everitt AR, et al.; GenISIS Investigators; MOSAIC Investigators (2012) IFITM3 restricts the morbidity and mortality associated with influenza. Nature 484:519–523.
21. Brass AL, et al. (2009) The IFITM proteins mediate cellular resistance to influenza A H1N1 virus, West Nile virus, and dengue virus. Cell 139:1243–1254.
22. Swiecki M, Wang Y, Gilfillan S, Lenschow DJ, Colonna M (2012) Cutting edge: Paradoxical roles of BST2/tetherin in promoting type I IFN response and viral infection. J Immunol 188:2488–2492.
23. Wang X, Hinson ER, Cresswell P (2007) The interferon-inducible protein viperin inhibits influenza virus release by perturbing lipid rafts. Cell Host Microbe 2:96–105.
24. Lenschow DJ, et al. (2007) IFN-stimulated gene 15 functions as a critical antiviral molecule against influenza, herpes, and Sindbis viruses. Proc Natl Acad Sci USA 104: 1371–1376.
25. Tang Q, Wang X, Gao G (2017) The short form of the zinc finger antiviral protein inhibits influenza A virus protein expression and is antagonized by the virus-encoded NS1. J Virol 91:e01909-16.
26. Arnheiter H, Skuntz S, Noteborn M, Chang S, Meier E (1990) Transgenic mice with intracellular immunity to influenza virus. Cell 62:51–61.
27. Kolb E, Laine E, Strehler D, Staeheli P (1992) Resistance to influenza virus infection of Mx transgenic mice expressing Mx protein under the control of two constitutive promoters. J Virol 66:1709–1716.
28. Haller O, Staeheli P, Kochs G (2007) Interferon-induced Mx proteins in antiviral host defense. Biochimie 89:812–818.
29. Allen EK, et al. (2017) SNP-mediated disruption of CTCF binding at the IFITM3 promoter is associated with risk of severe influenza in humans. Nat Med 23:975–983.
30. Randolph AG, et al.; Pediatric Acute Lung Injury and Sepsis Investigators (PALISI) Network Pediatric Influenza (PICFLU) Investigators; Pediatric Acute Lung Injury and Sepsis Investigators (PALISI) Network Pediatric Influenza (PICFLU) Investigators (2017) Evaluation of IFITM3 rs12252 association with severe pediatric influenza infection. J Infect Dis 216:14–21.
31. Mihaylova VT, et al. (2018) Regional differences in airway epithelial cells reveal tradeoff between defense against oxidative stress and defense against Rhinovirus. Cell Rep 24:3000–3007.e3.
32. Clary-Meinesz CF, Cosson J, Huitorel P, Blaive B (1992) Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biol Cell 76:335–338.
33. Daviskas E, et al. (1995) Changes in mucociliary clearance during and after isocapnic hyperventilation in asthmatic and healthy subjects. Eur Respir J 8:742–751.
34. Oozawa H, et al. (2012) Effect of prehydration on nasal mucociliary clearance in low relative humidity. Auris Nasus Larynx 39:48–52.
35. Moura FE, Perdigão AC, Siqueira MM (2009) Seasonality of influenza in the tropics: A distinct pattern in northeastern Brazil. Am J Trop Med Hyg 81:180–183.
36. Shek LP, Lee BW (2003) Epidemiology and seasonality of respiratory tract virus infections in the tropics. Paediatr Respir Rev 4:105–111.
37. Horisberger MA, Staeheli P, Haller O (1983) Interferon induces a unique protein in mouse cells bearing a gene for resistance to influenza-virus. Proc Natl Acad Sci USA 80:1910–1914.
38. Grimm D, et al. (2007) Replication fitness determines high virulence of influenza A virus in mice carrying functional Mx1 resistance gene. Proc Natl Acad Sci USA 104: 6806–6811.
39. Mastorakos P, et al. (2015) Highly compacted biodegradable DNA nanoparticles capable of overcoming the mucus barrier for inhaled lung gene therapy. Proc Natl Acad Sci USA 112:8720–8725.
40. Francis R, Lo C (2013) Ex vivo method for high resolution imaging of cilia motility in rodent airway epithelia. J Vis Exp, e50343.
41. Butler A, Hoffman P, Smibert P, Papalexi E, Satija R (2018) Integrating single-cell transcriptomic data across different conditions, technologies, and species. Nat Biotechnol 36:411–420.
42. Cohen M, et al. (2018) Lung single-cell signaling interaction map reveals basophil role in macrophage imprinting. Cell 175:1031–1044.e18.
43. Steuerman Y, et al. (2018) Dissection of influenza infection In Vivo by single-cell RNA sequencing. Cell Syst 6:679–691.e4.
44. Kudo E, et al. (2019) Low ambient humidity impairs barrier function, innate resistance against influenza infection. NCBI BioProject. Available at https://www.ncbi.nlm.nih.gov/ bioproject/PRJNA528197. Deposited March 20, 2019.
